肝細胞がんに対する新規治療法の臨床試験に世界で初めて成功 肝細胞がんの標準治療確立へ道筋
2019.12.04
- 医
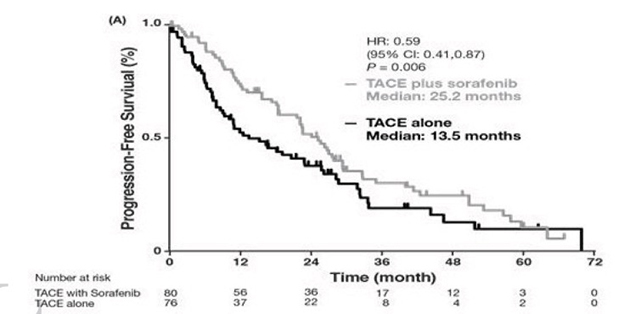
無増悪生存期間の違い TACE単独を上回っている
本研究成果により、TACEと分子標的薬の併用が世界の標準治療として定着し、治療ガイドラインを変えることにつながると期待されます。
本件に関する論文が、令和元年(2019年)12月4日(水)20:00(日本時間)、消化器分野の専門誌「GUT」(インパクトファクター17.943)にオンライン掲載されました。
【本件のポイント】
●TACEと分子標的薬併用の臨床試験に世界で初めて成功
●がん進行の新たな判断基準を作成し、ソラフェニブの早期かつ長期投与を可能に
●過去の失敗を教訓に行った今回の臨床試験成功の結果が世界の標準治療に
【本件の内容】
肝細胞がんは、日本人のがん死亡原因の第5位で、毎年約2万8千人の患者が亡くなられている難治がんの一つです。肝細胞がんのステージは4つで、ステージ1早期肝がん、ステージ2切除不能多発肝がん、ステージ3進行肝がん、ステージ4末期肝がんに分類されます。ステージ2の標準治療であるTACEは、肝臓内の血管である肝動脈を塞ぐことで、がん細胞に栄養を与えずに死滅させることを目的とした治療法です。ステージ2は進行がんや末期がんへの移行を防ぐための重要なステージですが、標準治療がTACEしか無く、症例によっては効果が乏しい場合もあるため、新しい治療法の開発が望まれていました。
そこで、TACEに、ステージ3で使用される分子標的薬を組み合わせることで、TACEの治療効果を向上させることを目的とした臨床試験が世界でこれまでに5件※4 行われましたが、TACEを上回る結果は得られていません。
これらの臨床試験を分析し、失敗の要因として、次の2点に着目しました。1つ目は、がんの進行を判定する指標に、一般的な化学療法のための基準を使用したため、まだTACEの効果が見込めるにも関わらず、がんが進行したと判定され、治療を中止せざるを得なくなったこと。2つ目は、ソラフェニブの投与をTACEの後に開始したことです。TACEを行うと、がん細胞は貧血状態になり、血液を得るために新たに血管を作るための物質である血管内皮細胞増殖因子※5(VEGF)を分泌します。TACE終了後にがん細胞が残存していた場合には、この物質の働きでがん細胞が活発に増殖や転移などの動きをすることがあります。
この2つの要因を克服するため、TACEに合わせたがん進行の判定基準を新たに作り、治療を長期間実施できるようしました。あわせて、ソラフェニブをTACEの前から投与開始しました。
この結果、がんが進行せず、安定した状態を保つ「無増悪生存期間」が、TACE単独の場合の13.5カ月から、25.2カ月に増加し、今回の治療法が明らかにTACEよりも有効であることが明らかになりました。
これにより、将来的にはTACEとソラフェニブの併用が標準治療として取り入れられることが期待されます。
【論文掲載】
論文名:Randomised, Multicenter Prospective Trial of Transarterial Chemoembolization(TACE)plus Sorafenib as Compared with TACE Alone in Patients with Hepatocellular Carcinoma:TACTICS Trial(肝細胞癌患者に対するTACE・ソラフェニブ併用療法とTACE単独療法の効果を比較する多施設共同前向き無作為化比較試験)
掲載誌:GUT(Impact Factor:17.943)
著 者:(1*)Masatoshi Kudo,(1)Kazuomi Ueshima,(2)Masafumi Ikeda,(3)Takuji Torimura,(4)Nobukazu Tanabe,(5)Hiroshi Aikata,(6)Namiki Izumi,(7)Takahiro Yamasaki,(8)Shunsuke Nojiri,(9)Keisuke Hino,(10)Hidetaka Tsumura,(11)Teiji Kuzuya,(12)Norio Isoda,(13)Kohichiroh Yasui,(14)Hajime Aino,(15)Akio Ido,(16)Naoto Kawabe,(17)Kazuhiko Nakao,(18)Yoshiyuki Wada,(19)Osamu Yokosuka,(20)Ken-ichi Yoshimura,(21)Takuji Okusaka,(22)Junji Furuse,(23)Norihiro Kokudo,(24)Kiwamu Okita,(25)Philip Johnson,(26)Yasuaki Arai
(1)近畿大学消化器内科、(2)国立がん研究センター東病院肝胆膵内科、(3)久留米大学消化器内科、(4)仙台医療センター消化器内科、(5)広島大学消化器代謝内科、(6)武蔵野赤十字病院消化器内科、(7)山口大学消化器内科、(8)名古屋市立大学消化器内科、(9)川崎医科大学肝胆膵内科、(10)兵庫県立がんセンター、(11)名古屋大学消化器内科、(12)自治医科大学消化器内科(13)京都府立医科大学消化器内科、(14)社会保険田川病院、(15)鹿児島大学生活習慣病・消化器内科、(16)藤田医科大学肝胆膵内科、(17)長崎大学消化器内科、(18)国立病院機構九州医療センター肝胆膵外科、(19)千葉大学消化器内科、(20)広島大学臨床研究センター医療統計解析部、(21)国立がん研究センター肝胆膵内科、(22)杏林大学腫瘍内科、(23)東京大学肝胆膵・移植外科(現、国立国際医療センター理事長)、(24)周南記念病院元病院長(山口大学名誉教授、日本肝臓学会元理事長)、(25)Liverpool大学(London)統計解析部門、(26)国立がん研究センター放射線診断科(前病院長、現、理事長補佐)
*工藤 正俊 = 責任著者(統括主任研究者)
【研究の詳細】
分子標的薬は本来、ステージ3の進行肝がんに対して開発された薬剤ですが、ステージ2の標準治療であるTACEと併用することにより、TACEの治療効果をさらに改善させ、無増悪生存期間や全生存期間※6 を延長させる可能性があるのではないか、との仮説が以前から立てられていました。その理論的根拠として、分子標的薬の投与により腫瘍血管が正常化する作用があること(通常の腫瘍血管は広狭不整のため薬剤の癌細胞への移行が悪い)や、VEGF阻害作用を有する分子標的薬の先行投与によりTACE後のVEGFの上昇が抑制されることが挙げられます。
この仮説をもとに、世界ではこれまで5件の臨床研究が行われましたが、TACEを上回る結果は得られませんでした。今回、研究グループは過去の臨床試験5つのうち、分子標的薬「ソラフェニブ」を使用した「Japan-Korea Post TACE試験」「SPACE試験」「TACE-2試験」の3つの臨床試験の方法と結果を詳細に分析し、これら3つの試験の失敗要因として次の2点に注目しました。
(1)病勢増悪の定義としてこの3つの試験では世界的に進行がんの治療効果判定の指標として用いられる一般的な基準であるRECIST基準※7 を使用したため、まだTACE治療ができる段階であるにも関わらずprotocol治療を中止せざるを得なかったため、ソラフェニブの投与期間が短かった。
(2)初回TACEの前に分子標的薬を使用せずTACEの後からソラフェニブ投与を開始した為に、TACEの後の血管内皮細胞増殖因子の上昇が抑制できず、TACEとソラフェニブの併用治療にても病勢進行を防げなかった。
研究グループは、この2点の失敗要因を克服するための工夫を臨床試験のデザインに採用し、無作為化割り付け前向き比較試験※8 で、今回の臨床試験(TACTICS試験※9)を実施しました。具体的に取り入れた新しい工夫は2点です。
(1)日常診療で用いられている基準をもとに、増悪の基準として、UnTACEable progression(TTUP※10)という概念を世界で初めて考案し、この増悪基準に達するまでソラフェニブを継続投与した。
(2)TACEの後の虚血状態の腫瘍から放出されるVEGFの上昇が増悪の原因であるため、これを防ぐため初回のTACEの2-3週間前からソラフェニブを先行投与した。ソラフェニブの先行投与により、ある程度の腫瘍の縮小・壊死効果を誘導、大きさがいびつな腫瘍血管を正常の血管サイズに戻す作用、後から追加する抗がん剤や塞栓物質を腫瘍内に均一に分布させることでTACEの効果を高めることなどが期待できる。
これらの工夫により、ソラフェニブの投与期間は38.7週間と劇的に長くなりました(過去の3試験の投与期間17-21週間)。これに加えてソラフェニブを2-3週間前から先行投与することにより(VEGFの放出が防げるため)TACEとTACEの間隔が併用群の方で有意に長くなり肝がん患者にとって最も重要な肝機能温存を達成することができました。さらに併用群の脈管浸潤や遠隔転移出現までの期間を有意に延長させることにより進行肝がんになるまでの時間も延長することができました。
その後TACEを加えるという併用療法により、TACE単独より約2倍近く無増悪生存期間を延⾧させる(25.2カ月 vs 13.5カ月)ことを証明しました(ハザード比※11 0.59,p=0.006)。
この新しい治療法は無増悪生存期間延⾧効果を証明したことにより世界の肝がんの治療体系を大きく変え、新しい標準治療法として位置づけられることが期待されます。
【用語説明】
※1 肝動脈塞栓療法(Transarterial Chemoembolization:TACE)
肝臓は肝動脈と門脈という2つの血管から栄養を取り入れています。肝臓がんは肝動脈のみから100%酸素と栄養を受けているため、カテーテルを通して肝動脈を完全に塞いで兵糧攻めにすることにより、がん細胞のみを死滅させる方法です。腫瘍のサイズや個数が少ない場合は、この方法は効果的ですがサイズが大きい場合や個数が多い場合はカテーテルを腫瘍の近くまで近づけることが難しくなり効果も悪くなるばかりか正常な周りの肝組織の細胞もある程度死滅してしまうので肝機能を悪くさせるのが欠点です。
※2 分子標的薬
正常の細胞も障害を受ける従来の抗がん剤とは異なり、がん細胞の増殖などに関わる特定の分子のみを狙い撃ちして、その働きを抑える薬です。肝がんの場合はソラフェニブ(ネクサバール)の他に、レンバチニブ(レンビマ)レゴラフェニブ(スチバーガー)、ラムシルマブ(サイラムザ)など4種類の薬が承認されています。
※3 無増悪生存期間 PFS(progression-free survival)
抗がん剤の治療成績の評価に一般的に用いられる指標であり、試験登録日もしくは治療開始日から病勢増悪もしくは死亡が確認されるまでの期間と定義されます。中央値を代表値として表現することが一般的です。
※4 過去実施された5件の臨床試験
1)Kudo M,et al.Phase III study of sorafenib after transarterial chemoembolisation in Japanese and Korean patients with unresectable hepatocellular carcinoma.Eur J Cancer 2011;47:2117-27.
2)Kudo M,et al.Brivanib as adjuvant therapy to transarterialchemoembolization in patients with hepatocellular carcinoma:a randomized phase III trial.Hepatology 2014;60:1697-707.
3)Lencioni R,et al.Sorafenib or placebo plus TACE with doxorubicin-eluting beads for intermediate stage HCC:the SPACE trial.J Hepatol 2016;64:1090-8.
4)Meyer T,et al.Sorafenib in combination with transarterial chemoembolisation in patients with unresectable hepatocellular carcinoma(TACE 2):a randomised placebo-controlled,double-blind,phase 3 trial.Lancet Gastroenterol Hepatol 2017;2:565-75.
5)Kudo M,et al.Orantinib versus placebo combined with transcatheter arterial chemoembolisation in patients wit unresectable hepatocellular carcinoma(ORIENTAL):a randomised,double-blind,placebo-controlled,multicentre,phase 3 study.Lancet Gastroenterol Hepatol 2018;3:37-46.
※5 血管内皮細胞増殖因子(Vascular Endotherial Growth Factor:VEGF)
癌細胞が虚血状態に陥ると自らの細胞が生き延びるために出す液性因子(サイトカイン)で、血管内皮細胞から放出される新生血管を作るための増殖因子の一種です。TACEなどにより虚血状態(低酸素状態)に陥った癌細胞は活発にVEGFを放出することにより腫瘍の増殖・進展・再発・転移を促進します。TACEを行った直後に低酸素状態になった癌細胞が残存するとかえって癌は活発に進行する場合があります。このVEGFをあらかじめ抑制する分子標的薬を先行投与しておくとこのような反応が起こりにくいということです。
※6 全生存期間(Overall Survival:OS)
抗がん剤の治療成績の評価に一般的に用いられる指標です。対象となる患者さんの試験登録日もしくは治療開始日から死亡が確認されるまでの期間と定義されます。中央値を代表値として表現することが一般的です。
※7 RECIST基準(Response Evaluation Criteria in the Solid Tumor)
通常、固形癌の化学療法の治療効果判定に使用されます。完全奏効(Complete response:CR)、部分奏効(Partial response:PR)、病勢安定(Stable disease:SD)、病勢進行(Progressive disease:PD)の4つに分けられます。病勢進行(PD)の判定は最初から存在する腫瘍(target lesion)のサイズが20%増大や新規病変の出現のみでその化学療法の効果はなくなり(耐性出現など)次のラインの治療法に移行すべき、ということを示します。これは主に進行がんに対する化学療法の治療効果判定においては適切ですが、TACEのように繰り返し治療ができる場合には新規病変の出現は必ずしもTACEの効果がなくなったとは言えず再度、肝内新病変に対してTACEを行えば効果が得られるためRECIST基準をTACEの治療効果判定に使用するのは適切ではありません。
※8 無作為化割り付け前向き比較試験(Rondomized Controlled Trial:RCT)
新規治療法や新規薬剤の有効性を検証するための科学的手法です。通常の後ろ向き試験では選択バイアスが入ってしまい、背景因子に偏りが生じてしまいます。新規治療法(薬剤)の効果を検証するための最もエビデンスレベルの高い方法がこの方法で、確認したい新規治療法とこれまでの標準治療群に通常1:1に無作為に割り付けて結果を見ることにより両群の背景は均一になり選択バイアスを排除できます。もう一つの背景因子をそろえる統計手法であるPropensity score matching(傾向スコアマッチング法)よりも更にエビデンスレベルが高く、診療ガイドラインなどは通常、この方法で証明された強いエビデンスを採用します。
※9 TACTICS 試験
今回の臨床試験の名称。Transarterial Chemoembolisation Therapy in Combination with Sorafenib as Compared with TACE Alone in Patients with Hepatocellular Carcinomaの頭文字をとったもの。
※10 Time to UnTACEable progression(TTUP)
TACEでメリットを受けなくなるまでの腫瘍状態増悪までの期間のこと。このUnTACEable progressionという増悪の定義は本臨床試験の中で初めて定義したものです。日常臨床においてこれ以上TACEを続けても生存延長効果はないであろうという基準を明確化してこの試験の増悪のためのTACE中止基準にしました。1.初回TACE前の腫瘍に比べて25%以上の増大、2.肝機能がChild-Pugh C class という非代償性の肝機能の状態に一過性になった時点、3.脈管浸潤の出現、4.遠隔転移の出現、のいずれか一つを満たした場合としました。この基準は日常診療の増悪と合致するものであり極めてreasonableな定義と言えます。
※11 ハザード比
ハザード比とは統計学上の用語で、臨床試験などで使用する相対的な危険度を客観的に比較する方法です。英語でHazard Ratio、略してHRとも言います。ある臨床試験で検討したい新治療法Aと比較対象の標準治療法Bとを比べたとき、ハザード比が1であれば2つの治療法に差はなく、ハザード比が1より小さい場合には治療Aの方が有効と判定され、その数値が小さいほど有効であるとされます。例えばA薬と対象のB薬を比較するというある臨床試験でハザード比が0.94という結果であれば、A薬はB薬よりリスクを6%減少させたという意味になります。今回の臨床試験のOSのハザード比は0.59ですので今回の新しい治療法がTACE単独治療に比べて病気の増悪リスクを41%下げた、と言えます。
【関連リンク】
医学部 医学科 教授 工藤 正俊(クドウ マサトシ)
https://www.kindai.ac.jp/meikan/569-kudou-masatoshi.html


