潰瘍性大腸炎とクローン病の発症メカニズムを解明 完治が困難な炎症性腸疾患の新たな治療法開発に期待
2022.09.29
- 医
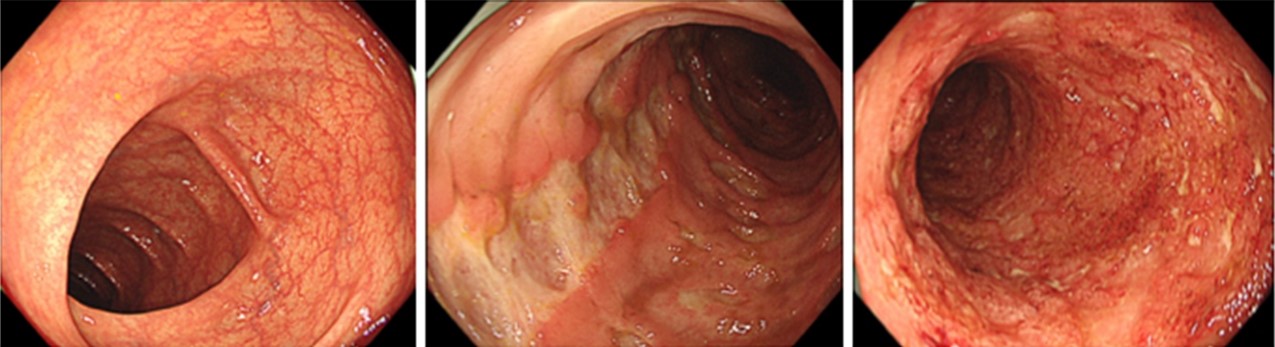
正常な大腸粘膜(左)、クローン病の大腸粘膜(中央)、潰瘍性大腸炎の大腸粘膜(右)
本件に関する論文が、令和4年(2022年)9月29日(木)午前10:00(日本時間)に、日本免疫学会が発行する国際的な学術誌"International Immunology"にオンライン掲載されました。
【本件のポイント】
●炎症性腸疾患の症状の悪化には、炎症性サイトカイン※2 の一つであるI型インターフェロン※3 が関与することを発見
●炎症性腸疾患の治療標的として、I型インターフェロンの活性を阻害する酵素を同定
●完治が難しいとされる炎症性腸疾患の新たな治療法開発につながる研究成果
【本件の背景】
炎症性腸疾患とは、下痢・血便・腹痛を主症状とする、指定難病に認定された免疫疾患で、潰瘍性大腸炎とクローン病に大きく区別されます。現在、潰瘍性大腸炎の国内患者数は約20万人、クローン病は約4万5千人と推定されており、患者数は年々増加しています。
潰瘍性大腸炎は大腸から直腸まで連続的に慢性炎症が生じ、クローン病は口から肛門までの全消化管に慢性炎症が生じる疾患です。どちらも、通常は免疫反応を起こすことがない腸内細菌に対して腸管の免疫細胞が反応し、炎症性サイトカインを産出することで炎症性腸疾患が起こります。炎症性サイトカインを中和する薬剤が開発されたことによって、病状はある程度コントロールできるようになりましたが、その薬を用いて病状が落ち着くのは患者の約50%であり、未だに多くの患者が症状に苦しんでいます。また、炎症性腸疾患には、病気が長期に及ぶと大腸がんが発生しやすくなるというリスクもあります。このような現状を踏まえ、炎症性腸疾患の発症メカニズムの解明に基づいた、新規治療法の開発が望まれています。
【本件の内容】
研究グループは、炎症性腸疾患のモデルマウスを用いて、症状悪化の原因が炎症性サイトカインの一つであるI型インターフェロン(以下、IFN)であることを明らかにしました。一方で、炎症性サイトカインのブレーキとして働くNOD2※4 というタンパク質が活性化されると、症状の悪化がほぼ完全に抑制されることも発見しました。このメカニズムについて検証したところ、活性化されたNOD2が特定の酵素を増加させることで、I型IFNの産生を抑制することが明らかになりました。
さらに、潰瘍性大腸炎とクローン病の患者の腸管組織を用いて分析したところ、クローン病患者の腸管粘膜では、治療により炎症が改善すると特定の酵素の発現量が増加し、I型IFNの産生量が減少することが明らかになりました。
本研究によって、I型IFNの活性を阻害する酵素が新しい治療標的として同定されたことで、完治が難しいとされる炎症性腸疾患の新たな治療法開発につながることが期待されます。
【論文掲載】
掲載誌:International Immunology(インパクトファクター:5.071@2021)
論文名:Activation of Nucleotide-Binding Oligomerization Domain 2 by Muramyl Dipeptide Negatively Regulates Toll-Like Receptor 9-Mediated Colonic Inflammation Through the Induction of Deubiquitinating Enzyme A Expression
(NOD2の活性化は、DUBAの発現を誘導することでTLR9を介した腸炎を制御する)
著者 :益田 康弘1、三長 孝輔1、栗本 真之1、瀬海 郁衣1、原 茜1、大丸 直哉1、岡井 夏輝1、大塚 康生1、高田 隆太郎1、吉川 智恵1、正木 翔1、鎌田 研1、本庶 元1、新井 康之2、山下 浩平2、工藤 正俊1、渡邉 智裕1* *責任著者
所属:1 近畿大学医学部内科学教室(消化器内科部門)
2 京都大学大学院医学研究科、医学部 血液・腫瘍内科
【研究の詳細】
腸管の免疫細胞であるマクロファージや樹状細胞は、細菌やウイルス感染を感知するToll様受容体※5 によって、腸内細菌を認識します。Toll様受容体が腸内細菌を認識すると、炎症性サイトカインが多量に放出され、炎症性腸疾患が引き起こされます。
研究グループは、クローン病発症の最大の危険因子として知られるNOD2の遺伝子変異が、どのようなメカニズムによりクローン病を引き起こすのか、2003年から研究を重ねてきました。その結果、先行研究によってNOD2がToll様受容体による炎症性サイトカインの産生にブレーキをかける重要な分子として、機能することを明らかにしました。
今回の研究では、まず、Toll様受容体の一つであるTLR9によるI型IFNの産生が、炎症性腸疾患の発症に及ぼす効果を検討しました。その結果、正常な野生型マウスとI型IFNの受容体が欠損したマウスを使用し、TLR9の活性化によるI型IFNの産生が、腸炎を悪化させることを確認しました。さらに、正常な野生型マウスとNOD2が欠損したマウスを使用し、マクロファージや樹状細胞においてNOD2が活性化されると、TLR9の活性化による腸炎の悪化がほぼ完全に抑制されることも発見しました。これらの結果より、腸炎のモデルマウスでは、NOD2がTLR9によるI型IFN反応にブレーキをかけることによって、腸炎の発症を防いでいることがわかりました。
そのメカニズムを解明するために細胞内シグナル伝達経路を解析したところ、NOD2が脱ユビキチン化酵素DUBA※6 の発現を増加させ、I型IFNの産生に必要な細胞内分子TRAF3※7 の活性化を抑制することを発見しました。つまり、NOD2はDUBAを活性化し、次にDUBAがTRAF3のユビキチン化※8 を阻害してI型IFNの産生を減少させ、腸炎の発症を防ぐことを確認しました。
次に、潰瘍性大腸炎患者およびクローン病患者の腸管組織を用いた検討を行いました。その結果、活動期の炎症性腸疾患の腸管組織では、炎症性サイトカインだけではなく、I型IFN関連炎症因子の発現が上昇しており、これらの産生量は治療によって症状が改善すると減少することが明らかになりました。特に、クローン病では、治療により症状が改善するとDUBAが増加し、DUBAの量はI型IFNと逆相関することがわかりました。
本研究ではNOD2がTLR9によるI型IFNの産生に及ぼす効果を解明し、その過程で炎症性腸疾患の新たな治療標的としてDUBAを同定しました。
【用語解説】
※1 クローン病:小腸や大腸の粘膜に炎症が起きる原因不明の疾患。特徴的な症状は腹痛、下痢、全身倦怠感、食欲不振、体重減少など。厚生労働省の難病対策における「特定疾患」の一つ。
※2 炎症性サイトカイン:主に免疫細胞が産生し、免疫反応を引き起こす液性のタンパク質。微生物感染の際には免疫防御に役立つが、定常時に過剰になると免疫疾患を引き起こす。
※3 I型インターフェロン:細胞から分泌されるタンパク質であるサイトカインの一種。微生物感染、特にウイルス感染の場合に多く産生され、免疫防御に重要な役割を果たす。一方で、非感染時に多く産生されると、免疫疾患を引き起こす。
※4 NOD2:Nuceltoide-binding oligomerization domain 2。細菌を認識する細胞質内に存在するタンパク質。その遺伝子変異は、クローン病、サルコイドーシス、結核、移植片拒絶反応などの様々な疾患を引き起こす。
※5 Toll様受容体:細胞の膜成分に存在し、細菌やウイルス感染を感知するシステム。微生物由来成分を認識し、炎症性サイトカインとI型IFNの産生を促進し、微生物排除に寄与する。過剰にこのシステムが働くと免疫疾患が起こる。ヒトではTLR1-TLR10まで10種類のTLRが同定されている。
※6 DUBA:Deubiquitinating enzyme A。細胞内に存在する脱ユビキチン化酵素。ユビキチンシステムを制御し、細胞内のシグナルを調節する役目を有する。
※7 TRAF3:TNF receptor-associated factor3。I型IFNの産生に重要な役割を果たす細胞内分子。
※8 ユビキチン化:翻訳後修飾の一つ。様々なユビキチン分子がユビキチン化酵素によって、標的タンパク質に付着し、細胞内のシグナル伝達は活性化されたり、抑制されたりする。また、ユビキチンを取り除く脱ユビキチン酵素が存在し、サイトカイン反応が制御される。
【関連リンク】
医学部 医学科 特命教授 渡邉 智裕(ワタナベ トモヒロ)
https://www.kindai.ac.jp/meikan/1505-watanabe-tomohiro.html
医学部 医学科 特命准教授 三長 孝輔(ミナガ コウスケ)
https://www.kindai.ac.jp/meikan/2000-minaga-kousuke.html
医学部 医学科 特命准教授 鎌田 研(カマタ ケン)
https://www.kindai.ac.jp/meikan/1640-kamata-ken.html
医学部 医学科 教授 工藤 正俊(クドウ マサトシ)
https://www.kindai.ac.jp/meikan/569-kudou-masatoshi.html
医学部
https://www.kindai.ac.jp/medicine/
Newscast本記事:https://newscast.jp/news/3990262


