優れた発光特性を有するキラルな多環式芳香族炭化水素の合成に成功 次世代3Dディスプレイ等への応用に期待
2020.03.25
軸性キラリティを有するPAHs
●軸性キラリティを有する多環式芳香族炭化水素の高エナンチオ選択的合成に成功した
●本法により合成された分子は優れた発光特性を有することを明らかにした
●次世代3Dディスプレイ、セキュリティーペイント等への応用が期待される
早稲田大学大学院先進理工学研究科博士後期課程 3年髙野 秀明(たかの ひであき)氏(日本学術振興会特別研究員)、同理工学術院の柴田 高範(しばた たかのり)教授、近畿大学大学院総合理工学研究科の今井 喜胤(いまい よしたね)准教授らの研究グループは、軸性キラリティ※1 を有する炭素、水素のみからなる多環式芳香族炭化水素(polycyclic aromatic hydrocarbons:略してPAHs)の高エナンチオ選択的合成※2 に成功しました。さらに、本法により合成された分子は優れた発光特性を有することを明らかにしました。
近年、PAHsは有機電子材料へ応用されるなど、次世代の有機分子として精力的に研究が行われています。特にキラル※3 なPAHsは特異な光学特性である円偏光発光(circularly polarized luminescence:CPL)特性※4 を有する場合があり、次世代の3Dディスプレイなどへの応用が期待されています。
今回、研究グループが開発した手法は、新規な有機反応への展開が期待できるほか、キラルPAHsの研究にさらなる発展をもたらす可能性があります。加えて、得られた分子は比較的優れた光学特性を有していたことから、今後、CPL特性を活用した3Dディスプレイ、セキュリティーペイント等への応用が期待されます。
本研究成果は、アメリカ化学会発行の『Journal of the American Chemical Society』のオンライン版に2020年2月12日に掲載され、3月11日に誌面掲載されました。
論文名 :Catalytic Enantioselective Synthesis of Axially Chiral Polycyclic Aromatic
Hydrocarbons(PAHs)via Regioselective C–C Bond Activation of Biphenylenes
掲載URL:https://pubs.acs.org/doi/10.1021/jacs.9b12205
(1)これまでの研究で分かっていたこと
多環式芳香族炭化水素(polycyclic aromatic hydrocarbons:略してPAHs)はベンゼン環が高度に連結した炭素、水素のみから構成される化合物です。近年、PAHsは有機電子材料へ応用されるなど、次世代の有機分子として精力的に研究が行われています。特にキラルなPAHsは特異な光学特性である円偏光発光(circularly polarized luminescence:CPL)特性を有する場合があり、次世代の3Dディスプレイなどへの応用が期待されています。
一方一般的にキラルなPAHsを得るためには、右手型分子と左手型分子が1:1で混合したラセミ体を合成し、キラルなカラムを用いてそれらを分離(光学分割)することが必要でした。より効率的な合成方法として、キラルな触媒を用いて、触媒的にキラルPAHsを得る手法も現在までに開発されています。しかしながら、その手法はらせん構造に由来するキラリティを持つPAHsにのみ限られており、軸性キラリティを有するPAHsのエナンチオ選択的合成の報告はありませんでした。
(2)今回の研究で新たに実現しようとしたこと、明らかになったこと
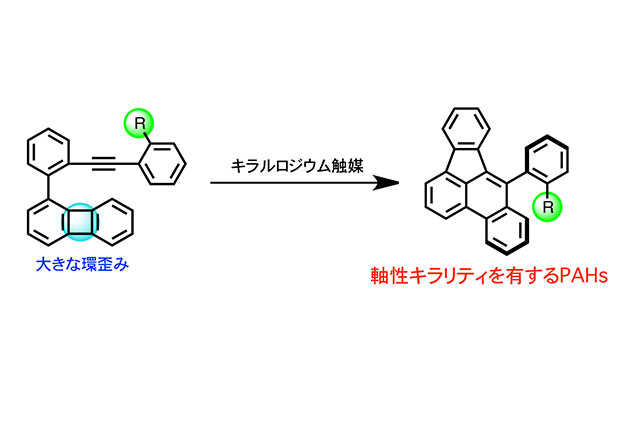
早稲田大学の研究グループ(大学院先進理工学研究科博士後期課程 3年髙野 秀明(日本学術振興会特別研究員)、同修士課程 1年塩澤 夏海、理工学術院Kyalo Stephen Kanyiva准教授、同 柴田 高範教授)と近畿大学の研究グループ(大学院総合理工学研究科 今井 喜胤 准教授)は、ふたつのベンゼン環からなるビフェニレンとアルキン部位が連結した化合物から、キラル遷移金属触媒を用いて軸性キラリティを有するPAHsのエナンチオ選択的合成に挑みました。
(3)そのために新しく開発した手法
今回用いたビフェニレンは、中央の四員環部分に大きな歪みを有しており、遷移金属触媒によって容易にその炭素―炭素結合を切断できることが知られています。しかしながら、置換基を持つビフェニレンの場合、置換基との立体的な反発を避け、置換基のない空いた炭素―炭素結合が選択的に切断を受けます。そこで本研究グループは、置換基部位に金属と相互作用するアルキン部位を導入することで、立体的に混み合った炭素―炭素結合へ触媒を接近させ、目的の炭素―炭素結合を選択的に切断する手法を開発しました。アルキン部位は金属を目的の場所に接近させる「配向基」の役割だけでなく、金属触媒と反応し新たな芳香族化合物へ変換するための「反応部位」としての役割もあります。それにより、4つのベンゼン環で構築されるベンゾフルオランテン誘導体を得ることに成功しました。またアルキン部位に置換基を持つベンゼン環を導入し、その置換基とベンゾフルオランテン骨格との立体反発により、軸性キラリティを構築しました。キラルロジウム触媒を用いる反応により、非常に高いエナンチオ選択性かつ非常に高い収率で軸性キラリティを有するPAHsの合成に成功しました。さらに反応部位を2つ有する化合物を用いることで7つのベンゼン環からなるキラルPAHsの効率合成も達成しました。また、得られたPAHの一つは、小分子として比較的優れたCPL特性を有していることを明らかにしました。
(4)研究の波及効果や社会的影響
今回用いた、アルキン部位を「配向基」かつ「反応部位」として用いる手法は、無駄な置換基を導入することなく目的化合物を合成する手法として、新規な有機反応への展開が期待できます。また、今回開発した反応は、右手型分子と左手型分子のうちの一方のみを選択的に得ることができる手法であるため、キラルPAHsの研究にさらなる発展をもたらす可能性があります。加えて、得られた分子は比較的優れた光学特性を有していたことから、今後、さらなる分子デザインにより、CPL特性を活用した技術(3Dディスプレイ、セキュリティーペイント等)への応用が期待されます。
(5)今後の課題
現時点での最適な条件は、反応温度が80度で、反応時間が24時間です。今後、より温和な条件、例えば、室温で1時間以内に反応が完結する触媒系の探索を行います。また、今回合成したキラルPAHsにはベンゾフルオランテン骨格が必ず含まれていますが、さらなる基質のデザインにより、多様な構造の軸性キラリティを有するPAHsを合成し、より光学特性の優れた化合物の創製を目指します。
(6)用語解説
※1 軸性キラリティ
ある化合物の単結合(軸)が置換基の立体反発により回転ができないことなどに由来し、その鏡像体と重ねることができないことを、軸性キラリティとよぶ。(図参照)
※2 高エナンチオ選択的合成
キラルな化合物において、鏡像関係にある右手型分子と左手型分子のうちの一方を選択的に作ること。
※3 キラル
ある現象の鏡像体が、元々の現象と重ねることができない性質のことを指す。
※4 円偏光発光(CPL)特性
光は垂直な面内で振動する波であるが、その振動面がらせん状に回転しながら進む光のことを円偏光といい、円偏光を発光する性質を円偏光発光特性という。
(7)論文情報
雑誌名:Journal of the American Chemical Society
論文名:Catalytic Enantioselective Synthesis of Axially Chiral Polycyclic Aromatic
Hydrocarbons(PAHs)via Regioselective C–C Bond Activation of Biphenylenes
執筆者名(所属機関名):
Hideaki Takano(Waseda University),Natsumi Shiozawa(Waseda University),Yoshitane Imai(Kindai University),Kyalo Stephen Kanyiva(Waseda University),Takanori Shibata(Waseda University)
誌面掲載日時(現地時間) :2020年3月11日
オンライン掲載日時(現地時間):2020年2月12日
掲載URL :https://pubs.acs.org/doi/10.1021/jacs.9b12205
DOI :10.1021/jacs.9b12205
(8)研究助成
研究費名 :科学研究費助成事業 特別研究員奨励費
研究課題名:触媒的不斉炭素ー炭素結合活性化反応を利用した歪んだ縮合多環式芳香族化合物の創製
研究代表者名(所属機関名):
髙野 秀明(早稲田大学大学院先進理工学研究科、日本学術振興会特別研究員(DC2))
【関連リンク】
理工学部 応用化学科 准教授 今井 喜胤(イマイ ヨシタネ)
https://www.kindai.ac.jp/meikan/362-imai-yoshitane.html


