Sae2 は異なるメカニズムで Mre11 エンドヌクレアーゼとエキソヌクレアーゼの活性を制御する
2024.08.22
- 研究報告
生物の遺伝情報の源であるゲノムDNAは細胞の中で絶えず傷を負っている。生物はその傷の種類に応じて正しい修復方法を備えており、遺伝情報が変更されないように守っている。たとえDNA上の傷を治しても、その傷がもとで遺伝情報が書き換わってしまうとその蓄積からいずれ細胞ががん化する。DNA二本鎖切断(DNA double-strand breaks: DSB)は重篤なDNA 損傷であると同時に、ゲノム編集の開始反応、そして我々の体の中でも免疫グロブリン遺伝子や配偶子の遺伝的多様性創出に利用されている。そのため、我々のゲノムDNA にDSB を引き起こす電離放射線や化学物質はがんのリスクを高めることが知られている。DSB が生じた際に正しい修復方法を選択する鍵因子、そしてがん抑制因子としてMre11 ヌクレアーゼが知られている。
これまでの研究からDSB 修復にMre11 の機能が必須であることがわかっていた。またMre11 タンパク質は、生化学的にはエンドヌクレアーゼと3'-5'エキソヌクレアーゼ活性という2つの活性があり、in vivo では損傷の状態に応じてこの2つの活性を使い分ける必要があると考えられてきた。一方でMre11 が細胞内で機能するにはさらにRad50 とSae(ヒトではCtIP)2の2つのタンパク質が必要である。しかし、どのようにしてMre11の2つの異なる酵素活性を切り替えるのか?どのようなときに2つの活性を使い分ける必要があるのかについては不明であった。その原因の一つとして、これまで誰もMre11の2つの酵素活性の片方にだけ欠損を示すような機能分離変異を単離できなかったことがあげられる。
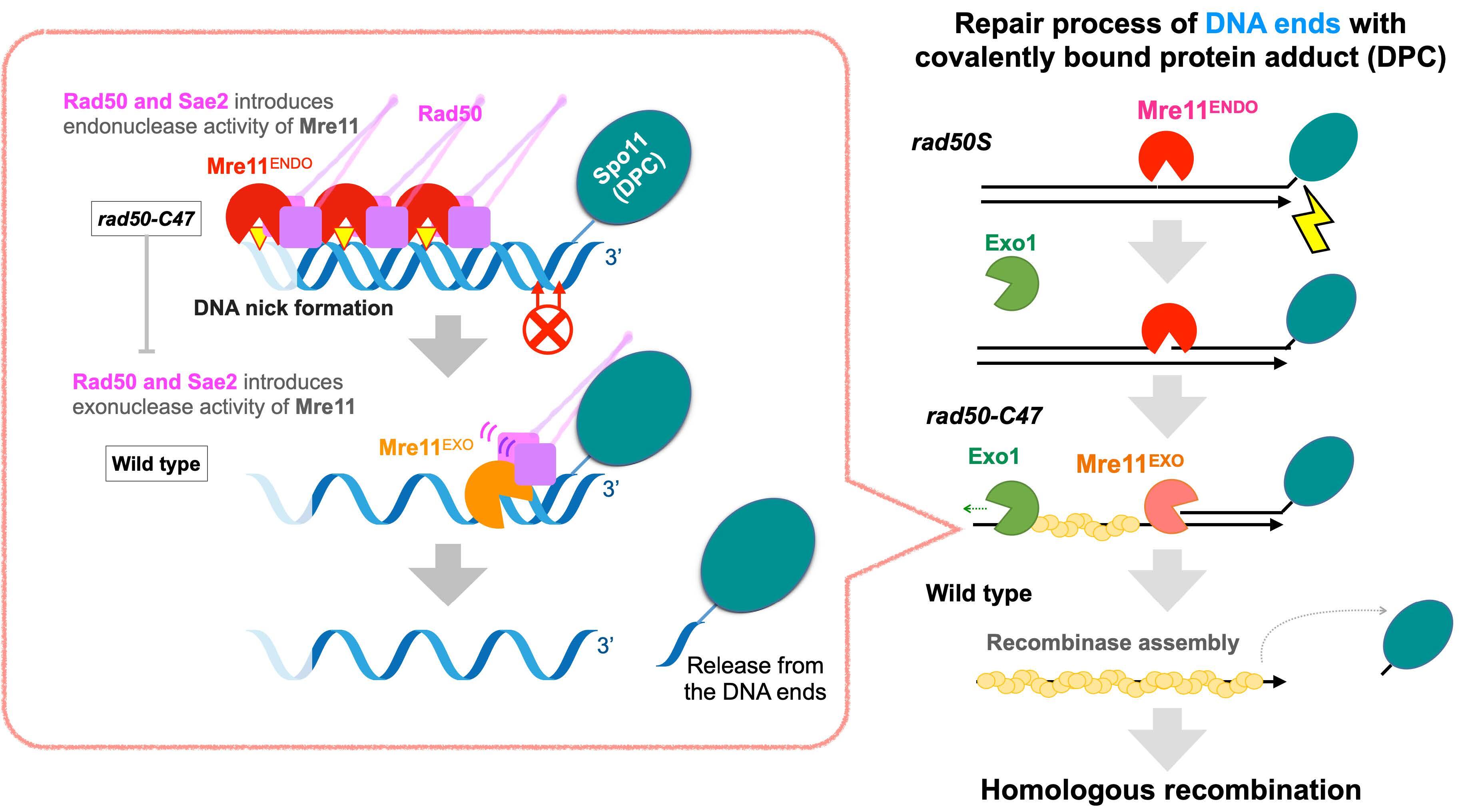
真核⽣物ではSae2/CtIPおよびMre11-Rad50-Xrs2/Nbs1複合体が、DSB修復経路の⼀つ、相同組換えの開始反応であるDSB末端の単鎖化に必須である。Mre11がDSB末端の単鎖化において、エンドと3ʼ-5ʼエキソヌクレアーゼの両活性を発揮し、それらを適宜切り替える必要があるが、その分⼦メカニズムと⽣理学的意義については理解が進んでいなかった。
私たちはRad50とSae2がMre11の活性転換を⾏っていると考え、rad50 変異の中からスクリーニングによってMre11のエキソ活性にのみ⽋損を⽰す出芽酵⺟rad50-C47 変異株の単離に初めて成功した。この変異を持った精製Rad50タンパク質とSae2タンパク質をもちいた⽣化学的なMre11ヌクレアーゼ活性解析によって、3ʼ-5ʼエキソヌクレアーゼ活性特異的に⽋損を⽰す事を明らかにした。この結果はSae2依存的にSMC様タンパク質Rad50の構造転換を介してMre11の活性転換が起きることを⽰唆している。
次にMre11の3ʼ-5ʼエキソヌクレアーゼ活性の⽣物学的意義を調べるために減数分裂期組換えを解析した。減数分裂期組換えはトポイソメラーゼ様Spo11によって導⼊されたDSBによって開始する。Spo11はDSB導⼊後、チロシン残基とDNAの共有結合を保ったまま15-30塩基のDNA断⽚と共に解離することが知られている。タンパク質付加物(DPC)が共有結合したDSBは修復が困難で抗がん剤などに利⽤されている。⼀種のDPCであるSpo11の解離と減数分裂期DSBの単鎖化についてrad50-C47 変異株で解析を⾏った。
その結果、Spo11が結合したDSB端から100塩基ほどの領域にはDNAのらせん間隔に合わせたMre11エンドヌクレアーゼに依存したDNAニックが導⼊され、またその外側には5ʼ-3ʼExo1依存的に単鎖領域が形成され、そこに組換え酵素Rad51が局在するが、DSB末端からはSpo11は解離せず、組換え産物も殆ど形成 されないことがわかった。⼀⽅で、rad50-C47 変異株においてはDSBの再結合による修復(NHEJ)やヘアピン構造を持つDNA末端の開裂と修復には⽋損がなく、この結果は、Mre11の3ʼ-5ʼエキソヌクレアーゼ活性は主にSpo11のような⼤きな付加物をDSB末端から外し、相同組換えを⾏うために必須である事を⽰唆している。
この研究はアグリ技研の篠原美紀教授および農学研究科バイオサイエンス専攻:⽟井智貴さん(当時M2)、尾尻⿓星さん(現M2)、森⽥⼀世さん(当時M2)と、イタリア スヴィッツェラ⼤学(スイス)およびニュージャージー州⽴ラトガース医科⼤学(アメリカ)の研究グループとの共同研究です。
研究概要