ヒトAAA+ ATPase FIGNL1はRAD51依存的なUltra-fine bridgeの形成を抑制する
2024.05.01
- 研究報告
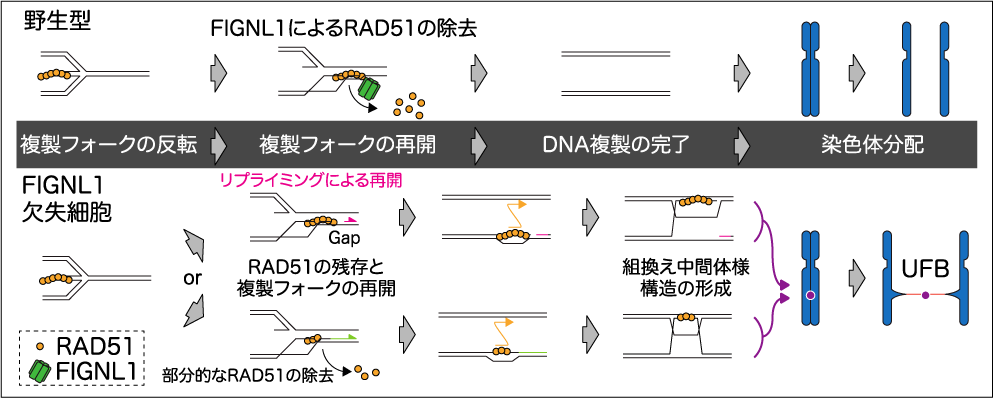
アグリ技術革新研究所所員の篠原美紀教授と農学部の松嵜健一郎講師は、相同組換えの中心的役割を担うRAD51が、染色体不分離の一種であるUltra-fine bridge(UFB)を引き起こすことを、ヒト培養細胞を用いた研究により明らかにしました。また、AAA+ ATPase FIGNL1が不適切なRAD51の染色体上への蓄積を防ぐことで、UFB形成を抑制していることも明らかにしました。
RAD51は、相同組換えとDNA複製の両方で重要な役割を担うリコンビナーゼです。相同組換えは、DNA二重鎖切断を修復する経路であり、切断部位のDNA配列から相同なDNA配列を探し、潜り込ませ、失われたDNA配列を合成することで修復を行なっています。RAD51はこの過程で、相同なDNA配列の検索とDNA鎖の侵入を行なっています。DNA複製では、複製フォークが停止した際にDNA分解酵素から新生鎖を保護する役割を担っています。このため、RAD51は染色体を安定に維持する上で必須のタンパク質です。一方で、RAD51の機能を抑制するタンパク質群が、これまで様々な生物種で多数報告されてきました。つまり、染色体を安定に維持するRAD51を必要に応じて抑制する必要があると考えられます。しかしながら、なぜRAD51を抑制しなければならないのか、その原因は不明なままでした。この謎を解くため、ヒト培養細胞でRAD51を抑制する機能を持つFIGNL1の欠失細胞を作製し、表現型の解析を行いました。その結果、FIGNL1欠失細胞では染色体分配の際に染色体間に細いDNAの架橋構造であるUFBが形成していることが分かりました。さらに、このUFBはRAD51に依存して形成していることも明らかにしました。今回の結果から、染色体を安定に維持するはずのRAD51が不適切に染色体上に残っていると、不必要なDNA鎖の検索や潜り込みを促進してしまい、最終的に分配される必要がある染色体同士を繋ぎ止めてしまっていると考えられます。
これは新しい種類の染色体不安定化であり、多くの生物がRAD51の機能を抑制するメカニズムを保持し続ける原因である可能性があります。この研究は大阪大学との共同研究の成果です。
研究概要
論文情報
